Effetti collaterali generalmente lievi e di breve durata
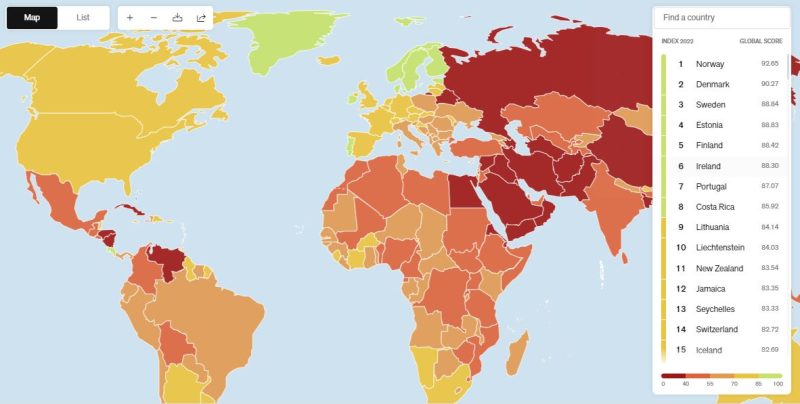
(DIRE) Roma, 30 Ago. – Il comitato per i medicinali per uso umano dell’Ema (Chmp) ha raccomandato l’autorizzazione del vaccino Comirnaty, indicato per contrastare la sottovariante Omicron XBB.1.5, nota come ‘Kraken’. Lo rende noto l’Agenzia europea per i medicinali. Secondo le raccomandazioni dell’Ema, il nuovo vaccino di Pfizer-BionTech deve essere utilizzato per prevenire il Covid-19 negli adulti e nei bambini a partire dai 6 mesi di età. L’Agenzia europea per i medicinali precisa che gli adulti e i bambini a partire dai cinque anni di età che necessitano di vaccinazione dovrebbero riceverne una singola dose, indipendentemente dalla loro storia vaccinale contro il Covid-19, mentre i bambini dai sei mesi ai quattro anni possono ricevere una o tre dosi a seconda che abbiano completato un ciclo di vaccinazione primaria o abbiano avuto il Covid-19.
Ema informa che prima di arrivare a questa decisione, il Chmp ha considerato tutti i dati disponibili su Comirnaty e sugli altri vaccini adattati, compresi i dati su sicurezza, efficacia e immunogenicità. Il Comitato ha valutato anche nuovi dati di laboratorio che mostrano una forte risposta del vaccino adattato contro XBB.1.5 e i ceppi correlati del virus che provoca il Covid-19. Dalla prima autorizzazione di Comirnaty, le autorità hanno acquisito una conoscenza approfondita sulla sicurezza del vaccino. Gli effetti collaterali sono generalmente lievi e di breve durata: comprendono mal di testa, diarrea, dolori articolari e muscolari, stanchezza, brividi, febbre e dolore o gonfiore nel sito di iniezione. Effetti collaterali più gravi possono verificarsi raramente. L’Ema invierà ora la raccomandazione del Chmp alla Commissione europea per una decisione giuridicamente vincolante a livello dell’Ue. Comirnaty è stato autorizzato per la prima volta nell’Ue nel dicembre 2020, con versioni adattate mirate ai ceppi BA.1 e BA.4-5 che hanno ottenuto un’ulteriore autorizzazione nel settembre 2022. (Fde/Dire) 16:05 30-08-23